综述:小分子固体口服制剂的连续生产

连续制造(Continuous manufacturing, CM)被定义为一个过程,在这个过程中,输入的材料被连续地输入和转换,加工的输出材料被连续地从系统中移除。连续生产可以被认为是符合FDA所谓的21世纪制药生产的“期望状态”,正如他们在2004年出版的《制药生产的创新和持续改进》中讨论的那样。然而,人们直到2014年才真正开始关注连续生产,而CM生产的第一个产品直到2015年才获批。这篇综述描述了引入CM工艺的一些好处和挑战,特别关注小分子固体口服剂型。对于希望更多地了解CM的个人来说,这篇综述是一个有用的介绍。
相关文章
介绍
对小分子固体口服剂型的连续制造(CM)这次审查提供了一个基本的介绍到CM过程的关键要素,给予一些关于这个问题的关键出版物引用,并提到了一些近期的发展和未来机会。对于主题的更深入的了解,请参阅Kleinebudde等。
Continuous manufacturing has been defined to ‘be a process in which the input material(s) are continuously fed into and transformed within the process, and the processed output materials are continuously removed from the system’, where ‘system’ is defined as an integrated process that consists of two- or more-unit operations
CM可以既药物物质制造和对药物产品被应用。开发原料药CM过程比药物产品一个比较复杂。两个CM过程之间的联系被描述为端至端或E2E制造(5.2节)(图1)。
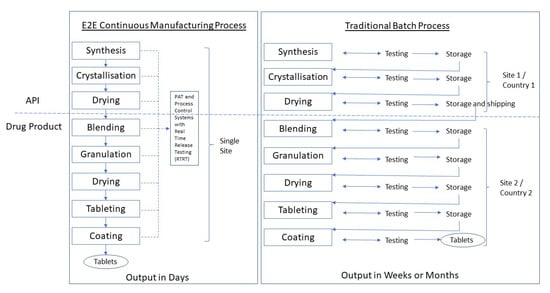
图1所示。连续制造端到端(E2E)工艺与传统批处理工艺的对比示意图。
注:API制造业历来发生的主要生产基地通常从药品网站,并经常在不同的(低税)的国家分开。
注:API制造业历来发生的主要生产基地通常从药品网站,并经常在不同的(低税)的国家分开。
2015年,CM生产的药品首次获得监管批准。自那以后,尽管监管机构鼓励,但行业的收购一直相当缓慢。到目前为止,已经有7项批准。其中一些产品结合了CM和批量生产。
一份研究报告指出,2018年连续制造的市场规模为23亿美元,并有可能以8.8%的复合年增长率增长,到2024年达到38亿美元
本文介绍了直接压片法、干造粒法和湿造粒法。这些过程在不断增加的复杂性中被列出。组成过程的一些单元操作本质上是连续的(例如,片剂压缩),而另一些操作则很难连续(例如,片剂压缩)涂层).CM可能包括几个连接到一个完全集成的药品系统和端到端系统的单元操作(其中的细节很少被公布)。
监管部门(EMA,MHRA,FDA和PDMA)具有CM的所有一直大力倡导特别是它的好处,以提高药品的质量控制,并产生更灵活的供应链。业界一直缓慢,主要采取的做法,由于其保守,对成本的影响和注册CM产品的潜在困难。监管机构认为,CM适合于需要新设施的NCEs或建立产品拓展市场。在CM大部分投资已经取得了大型制药公司与一些学术和不以营利为中心工作。有对CDMO(合同开发和制造组织)在CM参与的信息有限,虽然Patheon(赛默飞世尔科技),康泰伦特和Aesica已经提到让CM能力。对于仿制药公司参与的驱动是那些制药公司不同,初始投资和数据处理等技术要求,使他们参与的可能性较小。那里有学术中心和CDMOs之间的集线器发展CM过程的模型可能是前进的方向。继续阅读上连续制造审查
或在此下载全文(PDF):小分子固体口服制剂的连续生产
综述:小分子固体口服制剂的连续生产。药剂学
2021,13, 1311年。https://doi.org/10.3390/pharmaceutics13081311

